近日,我校中药学院李后开研究员团队联合曙光医院胡义扬教授及中国科学院上海药物研究所谢岑研究员团队在Nature Communications发表了题为Hyodeoxycholic acid ameliorates nonalcoholic fatty liver disease by inhibiting RAN-mediated PPARα nucleus-cytoplasm shuttling的研究论文,揭示了HDCA对NAFLD的治疗作用及其对肝脏脂质代谢调控的新机制。

中药猪胆来源于猪科动物猪的胆汁,具有清热、润燥、解毒之功效,在历代本草著作中多有记载。猪胆酸(Hyocholic acid, HCA)及猪脱氧胆酸(Hyodeoxycholic acid, HDCA)是中药猪胆的主要活性成分,其在人和啮齿类动物体内虽有分布,但含量甚少,属于内源性胆汁酸。近年来,围绕HCA类成分改善血糖稳态的研究受到了广泛的关注。HDCA作为猪胆中一类重要的胆汁酸,已经被证实具有降低胆固醇和改善糖稳态的作用。不过,HDCA在非酒精性脂肪肝(Nonalcoholic fatty liver disease, NAFLD)中的功效及机制研究报道甚少。
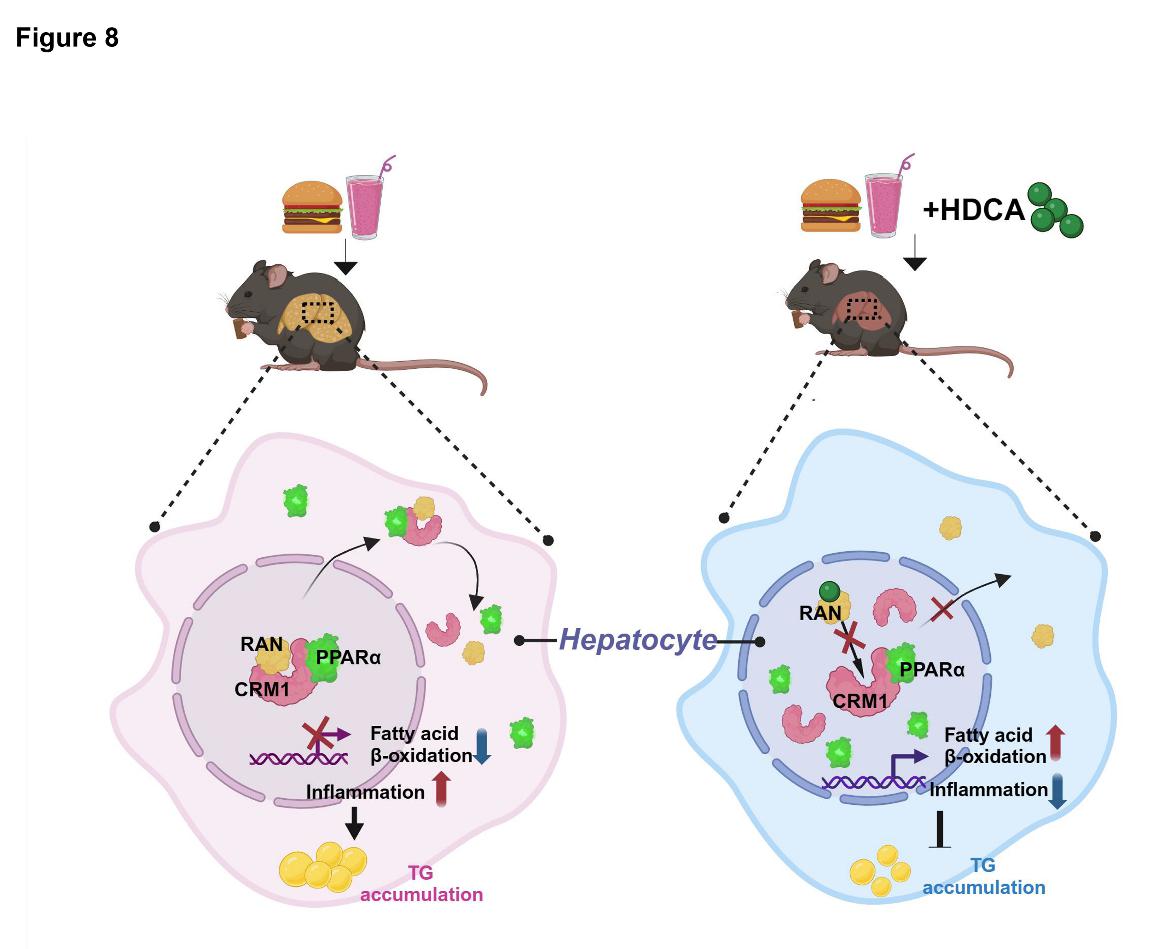
研究人员首先利用靶向代谢组学方法检测了临床NAFLD患者血清胆汁酸谱,发现NAFLD患者血清中HDCA类胆汁酸水平显著低于健康对照人群,且HDCA水平与NAFLD临床指征存在显著的负相关关系。因此,提出假设:通过饮食回补HDCA或许对NAFLD有治疗作用。利用饮食诱导的NAFLD小鼠,研究人员证实了饮食中添加一定量的HDCA可以显著改善NAFLD及各种代谢异常。由于饮食补充HDCA可以明显增加小鼠血清和肝脏组织中HDCA的暴露量,提示HDCA可能在肝细胞中具有直接调控靶标。为此,研究人员利用肝脏RNA_Seq及蛋白质组学方法,发现HDCA干预显著活化了肝细胞脂肪酸氧化信号通路,尤其是增加了PPARα蛋白在肝细胞核内的含量,且HDCA改善NAFLD作用依赖于肝脏PPARα蛋白。PPARα是调节机体代谢与炎症的关键转录因子,主要在肝组织中高表达,通过激活下游靶基因的转录来调节脂肪酸运输、脂肪酸氧化以及炎症免疫反应。因此,靶向激活PPARα信号通路一直被认为是治疗NAFLD的重要策略之一。研究人员进一步提出“HDCA如何增加PPARα蛋白在肝细胞核内含量”这一科学问题。利用蛋白芯片、免疫共沉淀、激光共聚焦与蛋白邻位连接等技术,发现并阐释了HDCA通过结合肝细胞内RAN蛋白(属于小G蛋白家族),干扰RAN和出核转运蛋白CRM1的结合,进而抑制RAN/CRM1/PPARα异三聚体的形成,抑制PPARα出核,增加肝细胞核内PPARα蛋白含量,促进脂肪酸氧化,并减轻炎症。
该研究阐释了HDCA进入肝细胞后靶向抑制RAN/CRM1/PPARα异源三聚体的形成,治疗NAFLD的新机制。该研究工作是与近期香港浸会大学贾伟教授领衔的另一项HDCA研究工作的背靠背研究,从不同角度阐释了HDCA除了能通过肠肝轴调控肝脏脂质代谢外,还可以直接进入肝细胞,靶向调控肝细胞内PPARα的细胞核内外穿梭过程,体现了中药活性成分在体内多途径、多靶标的作用特点。
我校中药学院2022届博士研究生钟婧(现为浙江省湖州市中心医院实验中心副研究员),2023届硕士研究生贺小芳(现为2023级博士研究生,导师为李后开)为论文共同第一作者。我校中药学院李后开研究员、盛丽莉副研究员、曙光医院胡义扬教授及中国科学院上海药物研究所谢岑研究员为论文共同通讯作者。研究工作得到我校交叉科学研究院化学生物学研究中心柯细松课题组、中国科学院上海药物研究所周虎课题组的大力支持。上海中医药大学为论文第一单位。该研究工作得到国家自然科学基金区域创新联合基金(重点项目)、国家自然科学基金面上项目、青年岐黄学者及上海市优秀学术带头人等项目的资助。(科技处、中药学院)

