我校屈祎课题组在Cell Reports发表论文揭示结肠癌治疗靶标β-catenin的降解新机制
我校交叉科学研究院中药化学生物学研究中心屈祎课题组继2022年2月在Cell Reports报道结肠癌关键治疗靶标β-catenin的新型蛋白互作及其靶向中药小分子LDA(Yan R, et al, Cell Reports 2022),最近又利用特异性小分子抑制剂,揭示β-catenin降解新机制,并鉴定β-catenin类泛素NEDD8修饰及其E3修饰酶β-TrCP2。基于相关结果的研究论文已经在最新一期的Cell Reports在线发表(Wang B, et al, Cell Reports 2022)。

经典Wnt信号通路(又称Wnt/β-catenin信号通路)是结肠癌公认的驱动因子,也是教科书最有代表性的信号通路之一。作为Wnt信号转导的功能效应分子,β-catenin的修饰和降解是Wnt信号通路和结肠癌发生发展进程的关键事件。值得注意的是,尽管β-catenin的泛素依赖性降解被建立了超过20年,但大多基于外源泛素过表达实验,鲜有功能缺失泛素系统的实验证据。作者利用泛素化E1酶UAE1的小分子抑制剂TAK-243,意外发现泛素抑制并不改变内源β-catenin的降解,进一步敲除β-TrCP1也证实了内源β-catenin降解的泛素非依赖性。在此基础上,作者鉴定了β-catenin的新型类泛素NEDD8修饰,并证实NEDD8修饰抑制剂MLN4924显著且快速阻断了β-catenin尤其是磷酸化β-catenin的降解。
该研究另一个主要发现是厘清β-catenin的泛素/类泛素E3酶。早在1998年就有报道果蝇的Slimb蛋白介导β-catenin的泛素修饰,Slimb在哺乳动物中有2个同源蛋白β-TrCP1和β-TrCP2,但大多数研究者在敲低β-TrCP时并没有区分这两个同源蛋白,使用的siRNA同时靶向这2个E3。本研究首先利用蛋白质谱鉴定β-catenin与β-TrCP1和β-TrCP2都有互作,再利用序列特异性siRNA发现,尽管2个E3都与β-catenin结合,只有β-TrCP2与β-catenin的NEDD8修饰和降解有关,且β-TrCP1和β-TrCP2在修饰β-catenin时各司其职:分别介导β-catenin的泛素和NEDD8修饰(图1)。这个工作不仅修正了β-TrCP1泛素修饰依赖β-catenin降解模型,并且鉴定了β-catenin降解相关的NEDD8修饰及其E3酶,为基于β-catenin降解的结肠癌靶向药物研究提供了新靶点。由于该工作挑战了经典Wnt信号通路模型,被审稿人认为是“这个领域具有挑衅性的有趣发现。”
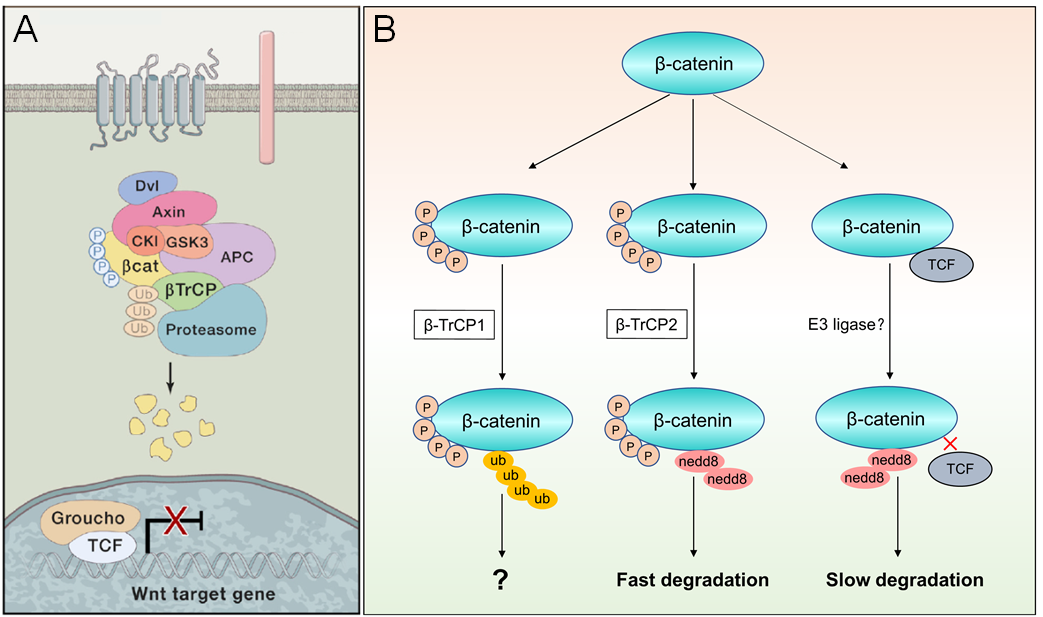
图1. β-catenin的翻译后修饰调控示意图。(A)在经典模型中,主要由泛素修饰介导β-catenin的降解(Nusse R and Clevers H, Cell. 2017);(B)本研究建立的修正模型中,NEDD8修饰不仅介导β-catenin的蛋白降解,还调控β-catenin与转录因子TCF4的蛋白互作(Wang B, et al, Cell Reports, 2022)。
该论文第一作者是交叉科学研究院2019级博士生王伯军,2019级硕士生王甜甜和朱慧敏为共同第一作者。交叉科学研究院屈祎研究员为通讯作者,柯细松研究员和上海科技大学郝丕良副研究员为共同通讯作者。该研究得到国家自然科学基金、上海市东方学者、曙光学者、上海市科委和教委重大项目以及上海市中药化学生物学前沿基地等项目的支持。(科技处、交叉科学研究院)
